Neuron:压力也能产生“蝴蝶效应”?崔一卉团队揭示“压力感应细胞”在慢性压力动物的抑郁情绪发生进程中发挥了重要作用
来源:生物探索 2024-10-16 09:52
崔一卉团队揭示了mLH与LHbM中各自存在一小群压力编码的“起始细胞”,构成了整条LH-LHb环路中的核心功能单位,在慢性压力过程中主导了抑郁的发生。
一只蝴蝶在热带雨林中轻轻扇动翅膀,这看似微不足道的动作却可能在几周后引发一场远在千里之外的风暴。压力如同蝴蝶扇动的翅膀,看似无害,却在一点一点悄然累积,最终引发心理风暴。
抑郁症已经成为最流行的精神疾病之一。全球约有2.8亿抑郁患者,每年造成约70万患者自杀,相关的全球疾病负担位居所有精神疾病之首【1】。在众多复杂病因中,压力是主要的风险因素之一【2】。目前大部分研究集中在抑郁发病的横断面,鲜少有人关注压力应激导致抑郁的“动态”机制,这在一定程度上阻碍了抑郁症的“及早预防”和“精准治疗”。厘清压力导致抑郁发生的始动环节、核心神经环路和特征分子,找到其动态变化规律是情绪领域和抑郁症研究中亟待解决的问题,有助于从根源上预防抑郁的发生,明确个体化病因,找到早期预防和诊断的新策略。
近年来的大量研究表明,不同的外界经历或刺激都可以只招募相应脑区中占比很低的一小群神经元,并且足以执行多种复杂的脑功能(如记忆、情绪效价、痛觉、进攻等)【3-5】。然而,至今仍不清楚是否存在一小群特异性响应压力刺激的神经元。这群“压力神经元”又是否参与调控抑郁样状态的发生。
2024年10月9日,浙江大学脑科学与脑医学院崔一卉团队在Neuron发表题为A small population of stress-responsive neurons in the hypothalamus-habenula circuit mediates development of depression-like behavior in mice的研究论文。
在这项研究中,他们利用活性依赖标记的病毒策略,在小鼠的外侧下丘脑(Lateral hypothalamus, LH)与外侧缰核(Lateral habenula, LHb)中分别鉴定出了一小群“压力神经元”,并且发现这群神经元在LH-LHb环路内部形成了感知压力的核心功能单位,随后通过LHb的局部微环路将压力信息传播至整个LHb,从而在慢性压力过程中主导了抑郁样状态的发生。因此这群细胞被定义为压力的“起始细胞”(starter cells)。

这项研究源自2020年团队的一个发现。当时研究人员以LHb为核心,绘制全脑的压力图谱【6】(Neuron 2022, figS1)。他们发现束缚应激激活的LH以及LHb脑区存在亚区特异性。无独有偶,在2017年一项来自韩国的团队Hoyong Park等人的研究中,研究者同样发现足部电击或束缚压力结合尾部电击都主要激活LHb内侧部【7】。这些发现引起团队的思考,多重压力是否激活同一群神经元?是否存在核团和亚区特异性?这群神经元在压力导致抑郁的过程中扮演怎样的角色?
围绕这些科学问题,研究团队全面探索和分析了以LHb为核心的多种压力刺激下的脑区激活图谱。我们发现多种压力刺激均能能激活投往LHb的LH神经元与LHb神经元中的一小部分(<10%)。这些神经元在解剖分布上具有亚区特异性,主要集中于外侧下丘脑中部(middle part of lateral hypothalamus, mLH)和外侧缰核内侧部(medial part of lateral habenula, LHbM)。基于之前与浙江大学邱爽教授的合作而建立的活性依赖标记Robust activity marking system(RAM 系统)【8】,团队继而通过标记并全面鉴定了一系列“压力神经元”相关的标记参数,证实了RAM系统标记“压力神经元”的可行性。
基于“压力神经元”的活性标记技术,研究人员结合化学遗传学的方法,发现仅仅抑制这一小群“压力神经元”就足以在慢性压力的诱导过程中阻断抑郁样行为的发生。这一结果直接提示了“压力神经元”对于抑郁发病的关键性。随后,团队解析了这一关键性背后的功能基础。利用Cre-on与Cre-off的病毒策略,团队建立了压力/非压力神经元的特异性双向标记技术,并通过光遗传与脑片电生理技术,全面鉴定了LH-LHb环路中不同神经元类群之间的突触功能连接。
结果显示,无论是在正常状态还是抑郁状态下,mLH与LHbM中压力神经元之间的突触连接强度均强于其他类群,在LH-LHb环路内部形成了一种压力相关的核心功能单位。有趣的是,这一核心功能单位在经历慢性压力后选择性地发生突触增强,形成了一种“强者恒强,强者更强”的突触现象。为了探究mLH-LHbM“压力神经元”环路对于抑郁发病的充分性,团队利用光遗传技术模拟压力刺激,发现激活该环路可以在未遭受压力的小鼠中诱发持久的抑郁样行为。这一系列证据提示mLH-LHbM“压力神经元”环路在LH-LHb环路内部主导了压力相关的神经活动,并且作为压力信息编码的“起始细胞”,传递压力相关的信息,进而介导了抑郁样行为的发生。
以往研究发现,LHb神经元在抑郁状态下呈现出整体性的活动增强。这提示在慢性压力诱导抑郁的过程中,除了少部分LHb的压力神经元,LHb的非压力神经元也产生了活动增强。通过系统性的电生理测定,团队发现在遭受慢性压力后,小鼠LHb的压力神经元和非压力神经元都产生了突触增强。然而,作为编码压力信息的LHb主要上游,LH的神经元中仅有一小群压力神经元能在LHb诱导突触增强,并且特异性地只产生在LHbM压力神经元中。所以其他LHb神经元类群的突触增强是如何形成的呢?
鉴于抑制LHbM压力神经元就足以阻止抑郁的发生,研究团队提出了一个假设:LHbM压力神经元可能作为压力的“起始细胞”,通过局部微环路将压力信息传递给其他的LHb非压力神经元。为此,研究人员通过光遗传学、脑片电生理与病毒追踪技术,在解剖和功能层面共同揭示了以往未被发现的LHb内部兴奋性微环路。值得注意的是,在经历慢性压力之后,正是LHbM压力神经元对LHb非压力神经元的兴奋性输入产生了突触增强。至此,团队人员找到了LHb不同类群神经元形成突触增强的原因:在慢性压力的积累过程中,mLH压力神经元编码压力信息,传递至LHbM压力神经元并且形成突触增强,随后通过LHb内部微环路将压力信息传递至LHb的非压力神经元,从而驱动LHb整体形成异常兴奋的状态,介导抑郁的发生。
LHb内部微环路驱动LHb整体过度兴奋的这一现象,提示在慢性压力过程中可能存在LHb神经元的动态招募。为了直接展示这一动态过程,团队在慢性压力的不同阶段标记了被压力激活的LHb神经元,发现压力激活的LHb神经元从最初局限在LHbM,逐渐扩散至整个LHb,激活强度递增。
总而言之,崔一卉团队揭示了mLH与LHbM中各自存在一小群压力编码的“起始细胞”,构成了整条LH-LHb环路中的核心功能单位,在慢性压力过程中主导了抑郁的发生(图1)。未来对压力“起始细胞”特征的精准鉴定,例如单细胞组学鉴定特异的生物标记物等,将揭示抗抑郁的精准神经元靶点。此外,这一基于活性依赖标记的研究思路,为解析神经环路内部的功能异质性、尤其是核心功能单位提供了新的视角。
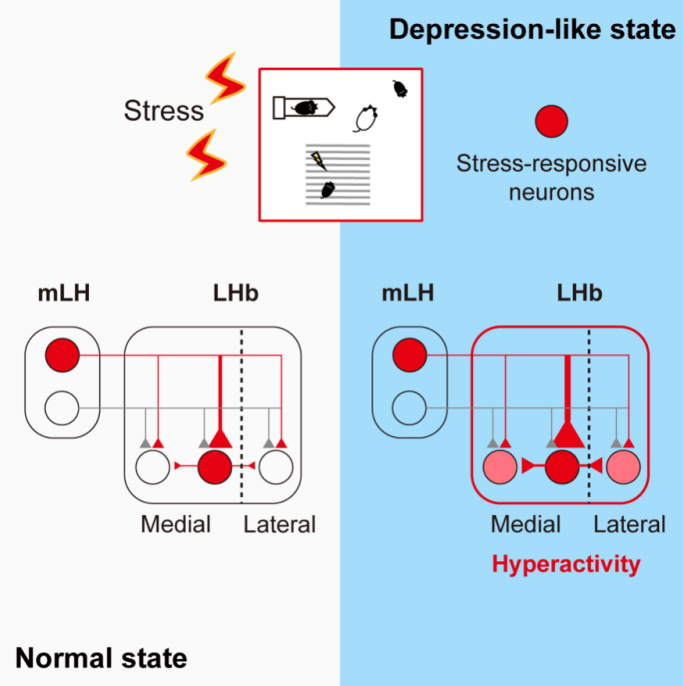
图1:压力神经元主导抑郁样状态的形成(Credit: Neuron)
参考文献
1. Collaborators, G.B.D.M.D. (2022). Global, regional, and national burden of 12 mental disorders in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet Psychiatry 9, 137-150. 10.1016/S2215-0366(21)00395-3.
2. McEwen, B.S., Bowles, N.P., Gray, J.D., Hill, M.N., Hunter, R.G., Karatsoreos, I.N., and Nasca, C. (2015). Mechanisms of stress in the brain. Nat Neurosci 18, 1353-1363. 10.1038/nn.4086.
3. Josselyn, S.A., and Tonegawa, S. (2020). Memory engrams: Recalling the past and imagining the future. Science 367. 10.1126/science.aaw4325.
4. Choucry, A., Nomoto, M., and Inokuchi, K. (2024). Engram mechanisms of memory linking and identity. Nature Reviews Neuroscience 25, 375-392. 10.1038/s41583-024-00814-0.
5. Timalsina, B., Lee, S., & Kaang, B. K. (2024). Advances in the labelling and selective manipulation of synapses. Nature reviews. Neuroscience, 10.1038/s41583-024-00851-9. Advance online publication. https://doi.org/10.1038/s41583-024-00851-9
6. Zheng, Z., Guo, C., Li, M., Yang, L., Liu, P., Zhang, X., Liu, Y., Guo, X., Cao, S., Dong, Y., et al. (2022). Hypothalamus-habenula potentiation encodes chronic stress experience and drives depression onset. Neuron 110, 1400-1415 e1406. 10.1016/j.neuron.2022.01.011.
7. Park H, Rhee J, Park K, Han JS, Malinow R, Chung C. Exposure to Stressors Facilitates Long-Term Synaptic Potentiation in the Lateral Habenula. J Neurosci. 37(25), 6021–6030. 10.1523/JNEUROSCI.2281-16.2017
8. Hua, S.S., Ding, J.J., Sun, T.C., Guo, C., Zhang, Y., Yu, Z.H., Cao, Y.Q., Zhong, L.H., Wu, Y., Guo, L.Y., et al. (2023). NMDA Receptor-Dependent Synaptic Potentiation via APPL1 Signaling Is Required for the Accessibility of a Prefrontal Neuronal Assembly in Retrieving Fear Extinction. Biol Psychiatry 94, 262-277. 10.1016/j.biopsych.2023.02.013.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


